引言
在生物医药技术快速发展下,血管内皮生长因子(VEGF)作为关键靶点在多种疾病机制中的作用日益明确,并推动治疗策略不断演进。VEGF在生理状态下通过调节血管生成与修复维持血管稳态,而其表达异常则与多种病理过程密切相关:如在肿瘤中促进血管新生与进展,在眼科疾病中参与脉络膜新生血管并导致视力损害。基于VEGF信号通路的干预策略已在肿瘤与眼科疾病治疗中取得显著成效,在组织修复及衰老相关病理过程中的调控潜力,也为相关研究提供了新方向。ACROBiosystems百普赛斯作为专注于生物药研发的全球化品牌,开发了覆盖不同种属、亚型和标签的VEGF家族蛋白,助力加速VEGF相关药物及疗法开发。
肿瘤治疗新格局:PD-1/VEGF联合疗法,再拓肿瘤治疗边界
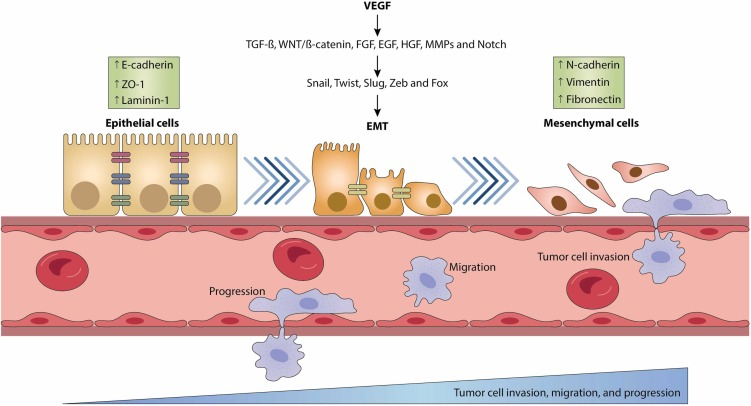
肿瘤微环境(TME)在癌症进展和转移中起关键作用,其中VEGF信号通路是调控肿瘤血管生成和免疫逃逸的核心因子。它通过诱导异常血管形成、上皮-间质转化(EMT)等机制,促进肿瘤生长、免疫抑制及转移[1],已成为重要治疗靶点。
https://doi.org/10.1016/j.biopha.2025.118023
VEGF信号通过肿瘤微环境内的复杂相互作用调节肿瘤的侵袭、迁移和转移
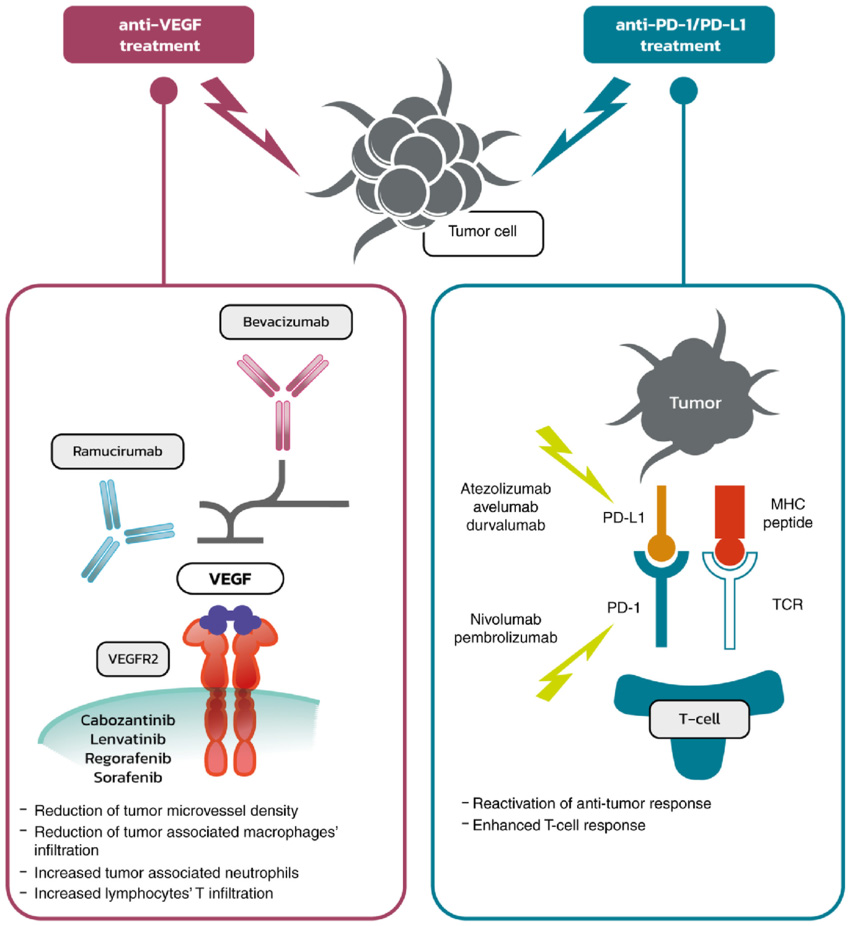
近年来,PD-1/VEGF双抗的开发将肿瘤免疫治疗推向新高度。传统PD-1抑制剂通过解除免疫抑制激活抗肿瘤免疫,但部分患者因TME免疫抑制特性反应有限。VEGF不仅促血管生成,亦可通过多种途径抑制免疫细胞功能,加剧TME的“免疫荒漠”状态。PD-1/VEGF双抗同时阻断VEGF与PD-1通路,兼具“抗血管生成+免疫激活”双重作用:一方面抑制血管生成,阻断肿瘤营养供应;另一方面激活免疫系统,增强肿瘤杀伤,显示出协同增效与扩大受益人群的潜力[2]。
https://doi.org/10.3892/ol.2022.13530
抗VEGF 和抗 PD-1/PD-L1 治疗作用机制
目前,PD-1/VEGF双抗已成为研发热点。例如,依沃西单抗作为全球首个获批的PD-1/VEGF双抗,在关键III期研究中显著延长肺癌患者生存期。国内企业如复宏汉霖、迈威生物、君实生物等也在积极推进相关临床试验。同时,PD-1/VEGF双抗与抗体偶联药物(ADC)的联合疗法成为前沿方向,信达生物、康方生物、辉瑞等企业已布局“双抗+ADC”策略,推动肿瘤治疗向更精准、联合的方向演进。随着研究的深入,PD-1/VEGF双抗及其联合疗法有望进一步提升疗效,重塑肿瘤治疗格局。
眼科疾病新突破:抗VEGF成“糖尿病”克星,国产创新药崭露头角
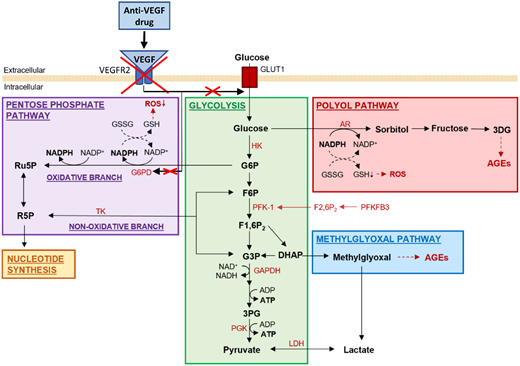
糖尿病视网膜病变这类眼底疾病的视力损害与VEGF的异常高表达密切相关。长期高血糖会刺激视网膜组织过量分泌VEGF,驱动病理性新生血管生成,最终导致不可逆性视力丧失。代谢层面,生理状态下糖酵解与磷酸戊糖旁路共同维持内皮细胞的能量与氧化还原稳态;高血糖则激活山梨醇、甲基乙二醛等异常旁路,诱发氧化应激。研究证实,VEGF可激活葡萄糖-6-磷酸脱氢酶,促进磷酸戊糖途径生成NADPH。抗VEGF治疗的重要机制之一是抑制该过程,减少NADPH产生。NADPH耗竭会削弱细胞抗氧化能力,加剧氧化应激,表现为谷胱甘肽减少和活性氧蓄积,从而影响内皮细胞功能[3]。
https://doi.org/10.1167/iovs.64.5.28
内皮细胞糖酵解作用以及可能受到抗VEGF疗法影响的三个糖酵解旁路途径
在抗VEGF药物问世前,此类疾病治疗手段有限,疗效常不理想。抗VEGF疗法可精准抑制异常VEGF活性,有效阻遏新生血管生成、减轻视网膜水肿与渗出,控制疾病进展,现已成为糖尿病视网膜病变、湿性年龄相关性黄斑变性等眼底疾病的一线治疗方案,显著改善了患者的视力预后。

根据国家药品监督管理局(NMPA)公开信息,2025年12月19日,国内首个自主研发的眼科抗VEGF单抗药物——百奥泰的维拉西塔单抗注射液上市申请已获正式受理。该药物如获批上市,将为患者提供新的治疗选择,在保障疗效的同时,提升药物可及性。
皮肤修复新范式:VEGF/EGF协同开启组织修复,解码“再生密码”
皮肤是人体最大的器官,在维持稳态和抵御外界伤害中起关键作用。虽具再生能力,但面对大面积或复杂创面常需外界干预。皮肤损伤后,局部缺氧会激活VEGF,进而促进内皮细胞增殖迁移,形成新生血管,并经周细胞包裹逐渐成熟,为修复区供氧供营养。另一关键因子表皮生长因子(EGF)则主导表皮重建。生理状态下EGF维持表皮正常更新;损伤后其浓度骤升10-15倍,通过激活信号通路抑制凋亡、促进表皮细胞分裂与分化,加速皮肤屏障恢复。因此,VEGF与EGF分别从血管新生和表皮再生两方面协同推动皮肤修复。
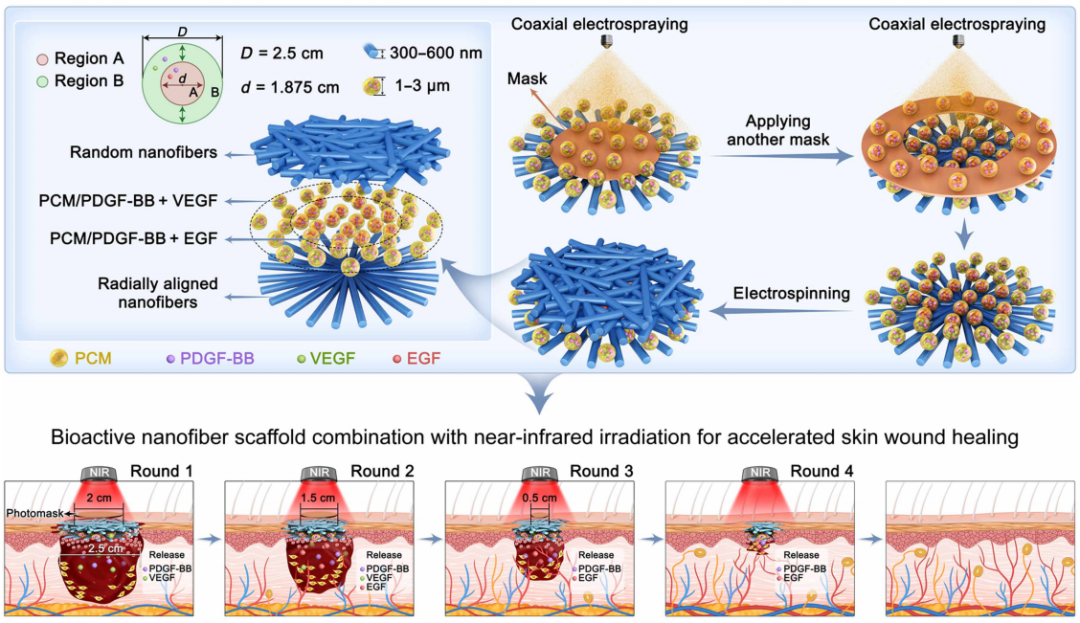
https://doi.org/10.1126/sciadv.adz5302
生物活性纳米纤维支架结合NIR 照射加速皮肤伤口愈合的示意图
Zhang等人研发了一种具有调控功能的生物活性支架。该支架通过分区负载不同生长因子——外围区域含血小板衍生生长因子B亚基(PDGF-BB)与VEGF,中心区域含PDGF-BB与EGF,并借助近红外光照射与可调光掩模技术,实现了生长因子在伤口愈合不同阶段的精准可控释放。这一设计不仅模拟了皮肤再生的自然时序性,更通过整合拓扑结构信号、可调控光热效应与持续生化信号传导,构建出动态响应伤口修复进程的仿生微环境[4]。
抗衰研究新方向:VEGF调控血管稳态,基因疗法探索长寿新路径
尽管遗传与环境因素可调控衰老进程,但现有研究提示血管衰老可能是驱动全身多器官功能退化的关键上游机制。Grunewald 等指出,血管系统的衰退可能率先引发多组织功能障碍[5]。同时,Thompson 等研究表明, VEGF与多巴胺信号通路是维持血管与神经健康的核心因素:VEGF 主要促进血管生成与组织修复,而多巴胺除调节神经活动外,亦参与调控血管张力,并可能对 VEGF 活性具有调节作用[6]。
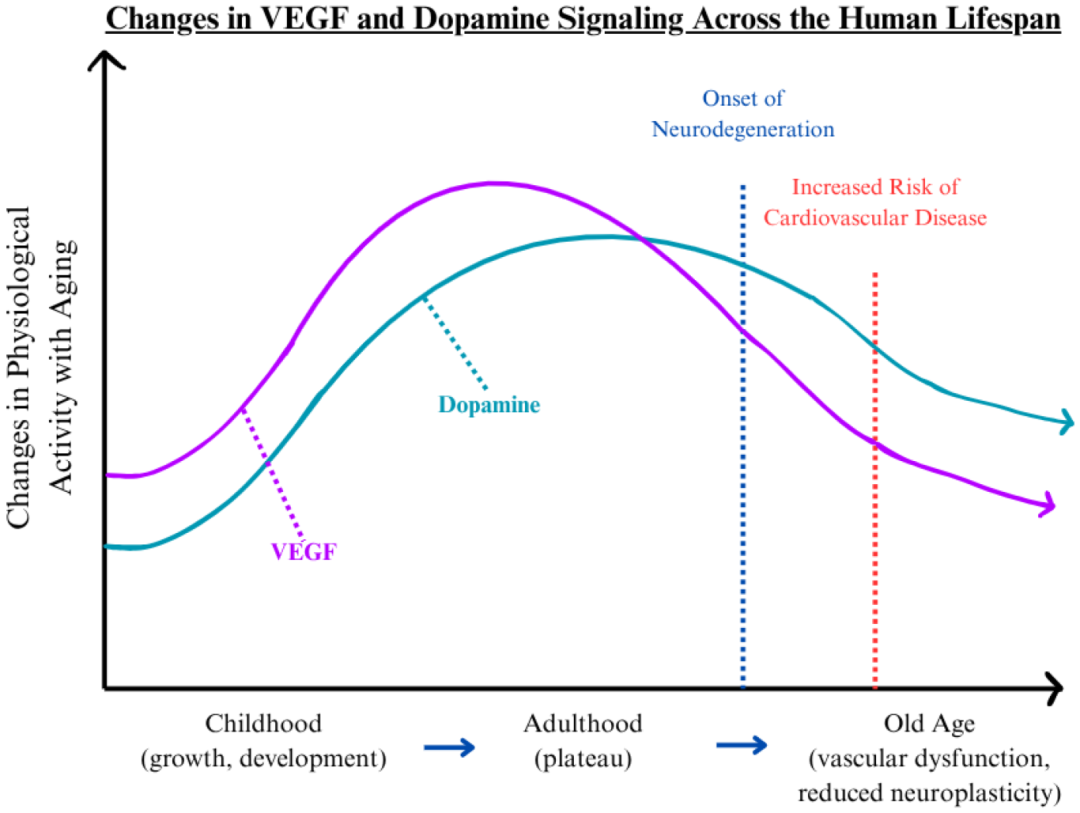
https://doi.org/10.3390/cells14151176
VEGF和多巴胺信号在人类生命周期中的变化
近日,由俄罗斯-以色列科学家伊万·Morgunov 创办的Unlimited Bio公司,计划在洪都拉斯和墨西哥的 clinics 开展人体试验,给健康志愿者注射两种基因疗法:一种靶向VEGF以增加肌肉供血,另一种瞄准卵泡抑素(Follistatin)以促进肌肉生长。更受关注的是,该公司宣称这两种疗法的组合不仅能提升运动表现,未来还可能用于治疗脱发和勃起功能障碍,甚至实现“激进的人类寿命延长”。目前这项研究虽处于早期且极具探索性,却标志着VEGF的应用想象正从疾病治疗向“健康增强”的边界拓展。
从肿瘤、眼病治疗的革命性突破,到组织修复的精准调控,再到抗衰老领域的大胆前瞻,VEGF的科学内涵与应用外延正在不断刷新。它已从一个重要的疾病靶点,演进为连接多种生理病理过程、开启治疗与健康管理新维度的核心钥匙。ACROBiosystems百普赛斯作为专注于生物药研发的全球化品牌,开发了覆盖不同种属、亚型和标签的VEGF家族蛋白,助力加速VEGF相关药物及疗法开发。
相关分子展示
| VEGF165 | VEGF121 | VEGF110 |
| VEGF164 | VEGF-B | VEGF-C |
| VEGF-D | VEGF R1 | VEGF R2 |
| VEGF R3 | PD-1 | EGF |
-
高生物活性经ELISA验证
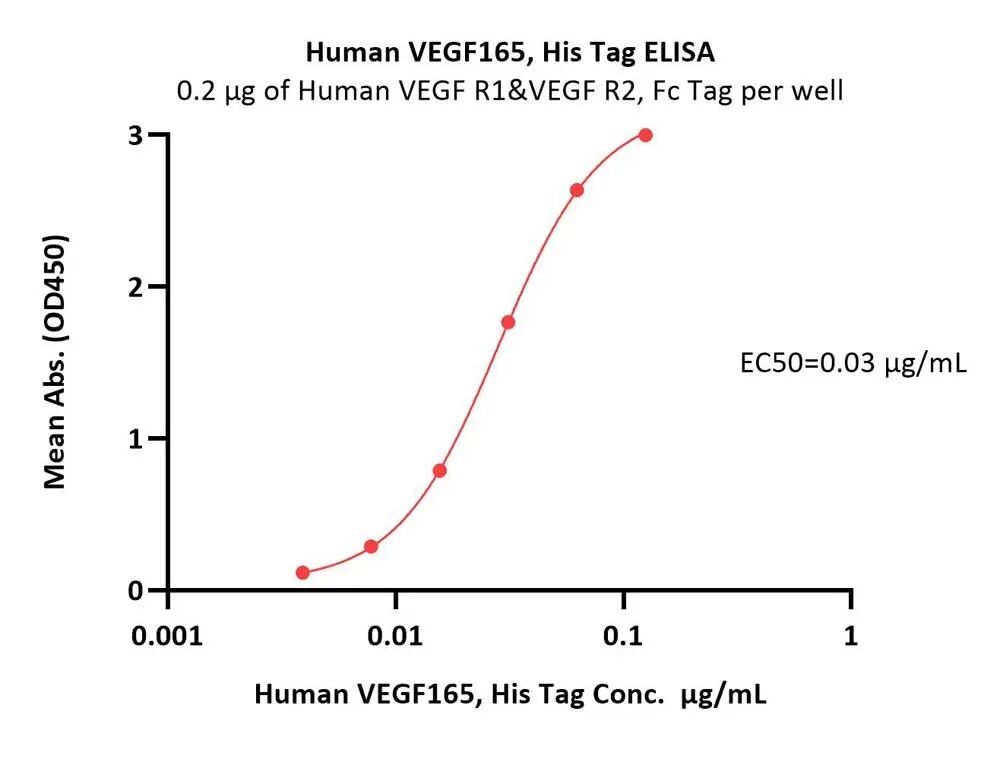
Immobilized Human VEGF R1&VEGF R2, Fc Tag at 2 μg/mL (100 μL/well) can bind Human VEGF165, His Tag (Cat. No. VE5-H5248) with a linear range of 0.004-0.063 μg/mL (QC tested).

-
亲和力经SPR验证
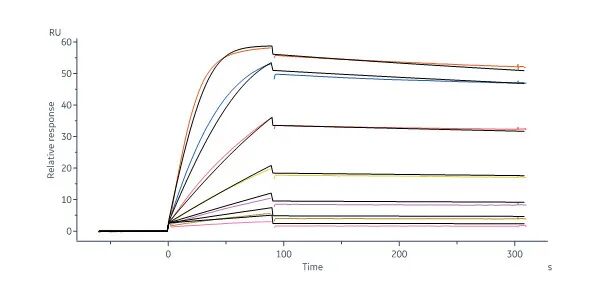
Human VEGF R1 Protein, Fc Tag (Cat. No. VE1-H5253) captured on Protein A Chip can bind Human VEGF-B, His Tag (Cat. No. VE6-H5225) with an affinity constant of 0.52 nM as determined in a SPR assay (Biacore 8K) (Routinely tested).

-
亲和力经BLI验证
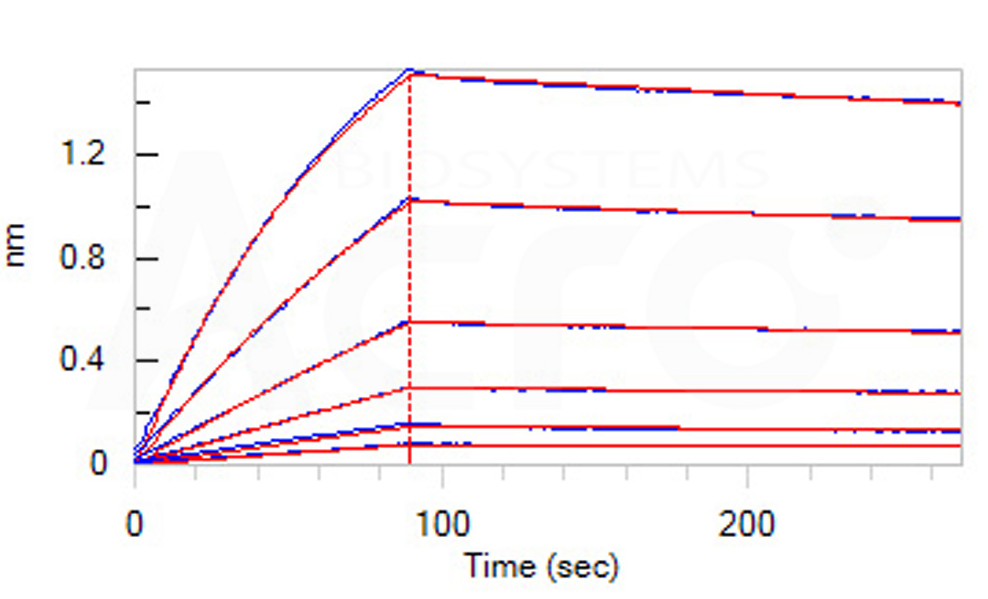



参考文献
1. Mahaki H, Nobari S, Tanzadehpanah H, et al. Targeting VEGF signaling for tumor microenvironment remodeling and metastasis inhibition: Therapeutic strategies and insights[J]. Biomedicine & Pharmacotherapy, 2025, 186: 118023. https://doi.org/10.1016/j.biopha.2025.118023
2. Gryziak M, Wozniak K, Kraj L, et al. The immune landscape of hepatocellular carcinoma-where we are?[J]. Oncology Letters, 2022, 24(5): 410. https://doi.org/10.3892/ol.2022.13530
3. Sharma D, Zachary I, Jia H. Mechanisms of acquired resistance to anti-VEGF therapy for neovascular eye diseases[J]. Investigative Ophthalmology & Visual Science, 2023, 64(5): 28-28. https://doi.org/10.1167/iovs.64.5.28
4. Zhang X, Gong B, Rao F, et al. Spatiotemporally controlled delivery of biological effectors from nanofiber scaffolds accelerates skin wound healing in porcine models[J]. Science Advances, 2025, 11(42): eadz5302. https://doi.org/10.1126/sciadv.adz5302
5. Grunewald M, Kumar S, Sharife H, et al. Counteracting age-related VEGF signaling insufficiency promotes healthy aging and extends life span[J]. Science, 2021, 373(6554): eabc8479. https://doi.org/10.1126/science.abc8479
6. Thompson M B, Tirupattur S P, Vishwakarma N, et al. Essential pieces of the puzzle: the roles of VEGF and dopamine in aging[J]. Cells, 2025, 14(15): 1178. https://doi.org/10.3390/cells14151178

ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)
